Prosigna și Resident Laboratory vă oferă cele mai relevante informații pentru deciziile privind tratamentul cancerului mamar.
Rezultate precise, decizii informate.

Rezultate precise, decizii informate.

Conform datelor statistice furnizate de ECIS (European Cancer Information System), cancerul mamar este cel mai frecvent tip de cancer din Uniunea Europeană. În anul 2022, au fost înregistrate 374.800 de cazuri noi, iar mortalitatea asociată acestei boli a cauzat 95.800 de decese.
Prosigna – testul nr. 1 al cancerului mamar
Informații mai cuprinzătoare despre riscul de recurență
Prosigna oferă trei informații esențiale, specifice fiecărui caz:
– grup de risc (scăzut, intermediar, crescut)
– scorul de risc de recidivă (ROR)
– subtip intrinsec (Luminal A, Luminal B, HER2-enriched, Basal-like)
Prosigna ajută la identificarea mai precisă a grupurilor cu risc și al probabilității de metastază în comparație cu testele genomice mai vechi (de ex. Oncotype DX).
De asemenea, poate oferi informații mai relevante pentru deciziile de tratament.

Datele aferente studiul TransATAC¹, care identifică riscul de recurență la distanță de 10 ani al pacienților, arată că atunci când rezultatele sunt discordante între Prosigna și Oncotype DX, testul Prosigna este mai precis.
Cu testele de 1-a generație, aproape 20% dintre pacientele pot fi repartizate greșit într-un grup cu risc scăzut, riscând să nu primească chimioterapia care le-ar putea salva viața. Prosigna oferă informații mai precise și mai relevante pentru deciziile terapeutice decât soluțiile concurente.
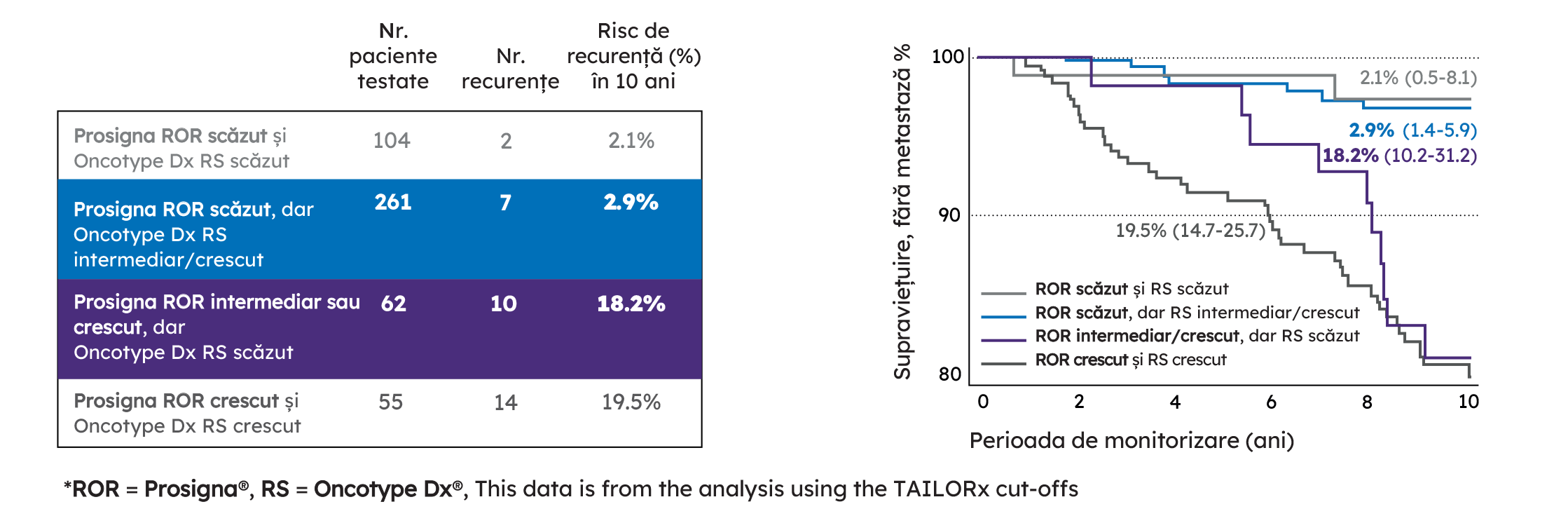
Pacientele evaluate ca având risc scăzut prin testul Prosigna, dar considerate cu risc intermediar sau crescut prin testul Oncotype Dx, au înregistrat o rată de 2.9% a recidivelor la distanță pe o durată de 10 ani, tratându-se doar cu terapie hormonală.
Pe baza rezultatelor testului Prosigna, aceste paciente ar putea primi tratamentul potrivit și s-ar putea evita tratamentul excesiv și consecințele posibile asociate pe termen lung.
Pacientele clasificate ca având risc intermediar sau crescut conform testului Prosigna, dar cu risc scăzut conform testului Oncotype DX, au prezentat un risc crescut de recurență la 10 ani de 18,2%.
Pe baza rezultatelor testului Oncotype DX, aceste paciente nu ar fi beneficiat, posibil, de abordarea terapeutică potrivită pentru a reduce riscul de recurență.
Atunci când testul Prosigna determină categoria de risc a unui pacient, rezultatele pot fi considerate de încredere.
Prosigna oferă informații prognostice la distanță mai precise decât Oncotype DX ²,³.
Prognosticul exact este baza recomandărilor de tratament.
Riscul de recurență al unui pacient este un factor cheie în decizia privind tratamentul recomandat în cancerul de sân ER+/HER2-⁴.
Prosigna este o analiză aprobată de FDA și certificată CE-IVD, fiind singurul test de profilare a expresiei genice (GEP) aprobat pentru utilizare în mai multe țări din întreaga lume.
NCCN
Ghidurile de practică clinică în oncologie (NCCN Guidelines®)**
St. Gallen
Panelul Consensus
Când și cum se efectuează testul meu Prosigna?
În Europa, Prosigna este susținut de principalele agenții de evaluare a tehnologiilor medicale (HTA) și/sau factorii de decizie, precum:
Analiza cancerului de sân – Prosigna® este un test diagnostic in vitro care utilizează profilul de expresie genică al celulelor găsite în țesutul cancerului de sân pentru a evalua riscul de recurență la distanță al unui pacient. Testul evaluează profilul de expresie genică folosind ARN extras din țesutul tumoral mamar fixat în formalină și încorporat în parafină (FFPE). Datele de expresie genică sunt ponderate împreună cu variabile clinice pentru a genera atât un subtip (luminal A, luminal B, HER2-enriched (îmbogățit) sau bazal-like), cât și un scor indicativ al probabilității de recurență la distanță a bolii. Testul este realizat pe platforma Nanostring nCounter® folosind țesut tumoral mamar FFPE diagnosticat anterior ca carcinom mamar invaziv. Analiza cancerului de sân – Prosigna® este indicat pentru pacienții cu cancer mamar care au suferit fie mastectomie, fie terapie de conservare a sânului, în combinație cu tratamentul locoregional conform standardului de îngrijire, fie ca:
a. Un indicator prognostic pentru supraviețuirea fără recurență la distanță la 10 ani la femeile aflate în postmenopauză, cu cancer de sân în stadiul I sau II, receptor hormonal pozitiv (HR+), fără afectare ganglionară, care urmează să fie tratate doar cu terapie endocrină adjuvantă, atunci când este utilizat împreună cu alți factori clinicopatologici.
b. Un indicator prognostic pentru supraviețuirea fără recurență la distanță la 10 ani la femeile aflate în postmenopauză, cu cancer de sân în stadiul II sau IIIA, receptor hormonal pozitiv (HR+), cu ganglioni limfatici pozitivi (1-3 ganglioni pozitivi), care urmează să fie tratate doar cu terapie endocrină adjuvantă, atunci când este utilizat împreună cu alți factori clinicopatologici.
*prețul social reprezintă o inițiativă menită să asigure accesibilitatea la serviciile noastre medicale de calitate pentru categorii defavorizate ale populației, inclusiv pacienți minori, studenți, pensionari sau persoane cu venituri nete sub 3500 RON/lună. Acest concept reflectă angajamentul nostru de a oferi asistență medicală accesibilă și de calitate, contribuind astfel la îmbunătățirea sănătății comunității în ansamblu.
* ASCO și ESMO sunt mărci înregistrate ale Societății Americane de Oncologie Clinică și Societății Europene de Oncologie Medicală. ASCO, ESMO, Institutul Național pentru Sănătate și Îngrijire (NICE) și Panelul de Consens Internațional St. Gallen nu susțin niciun produs sau terapie.
** NCCN recomandă testul cu 50 de gene (Prosigna) ca opțiune pentru pacienții potriviți cu cancere de sân pN0 și pN1. Cu permisiunea Ghidurilor de practică clinică în oncologie ale NCCN (NCCN Guidelines®) pentru Cancerul de Sân V.4.2023. © National Comprehensive Cancer Network, Inc. 2023. Toate drepturile rezervate. Accesat [30 august 2023]. Pentru a vizualiza cea mai recentă și completă versiune a ghidului, accesați NCCN.org.
NCCN = National Comprehensive Cancer Network® (NCCN®).
ASCO: Societatea Americană de Oncologie Clinică; ESMO: Societatea Europeană de Oncologie Medicală; FFPE: fixat în formalină și inclus în parafină; HR: receptor hormonal; NICE: Institutul Național pentru Sănătate și Îngrijire; AGO: Grupul German de Oncologie Ginecologică; SEOM: Societatea Spaniolă de Oncologie Medicală.
1. Sestak, I, et al. Clasificare discordantă și rezultate între Prosigna ROR și Oncotype DX RS pentru cancerul de sân ER-pozitiv, HER2-negativ, fără afectare limfatică: o analiză exploratorie a studiului TransATAC. Poster prezentat la: SABCS: 10-14 decembrie 2019, San Antonio, TX.
2. Gnant M, et al. Ann Oncol. 2014;25(2):339-45.
3. Dowsett M, et al. J Clin Oncol. 2013;31(22):2783-2790.
4. Marie Alexandre et al. Cancer Manag Res. 2019.
Testul de semnătură genetică prognostică pentru cancerul de sân Prosigna® (Prosigna assay) pentru utilizare pe sistemul de analiză nCounter® este aprobat prin 510(k) și marcă CE pentru utilizare în diagnosticul in vitro în prognostic și rezecție chirurgicală. Vă rugăm să consultați Inserția Specifică pentru Regiune pentru revendicările de produs respective. Subtipurile moleculare intrinseci nu sunt raportate de testul Prosigna aprobat de FDA în Statele Unite. Cu toate acestea, subtipurile moleculare intrinseci identificate de semnătura genetică sunt utilizate de algoritm pentru a calcula Scorul Prosigna (ROR) și categoria de risc. Prosigna® în asociere cu sistemul de analiză nCounter® este marcă CE pentru utilizare în diagnosticul in vitro la femeile postmenopauzale cu cancer de sân stadiul I sau II, receptor hormonal pozitiv (HR+), fără afectare a ganglionilor limfatici și femeile postmenopauzale cu cancer de sân stadiul II și IIIA, receptor hormonal pozitiv (HR+), cu afectare a 1-3 noduli limfatici, care urmează să fie tratate cu terapie hormonală adjuvantă. Consultați Inserția Produsului pentru mai multe detalii pe prosigna.com.